


美国FDA在10月19号发布了一个EUA,批准了Aptitude Medical的非处方唾液的COVID分子测试。这是第一个使用唾液作为样本的OTC分子测试。
它被命名为Metrix COVID-19测试,是一种一次性测试,被批准用于家庭自测,检测SARS-CoV-2病毒的核酸。它使用逆转录环介导等温扩增(RT-LAMP),结合电化学技术,使用配套的Reader自动分析电化学信号,在30分钟内完成检测,并且报告结果。
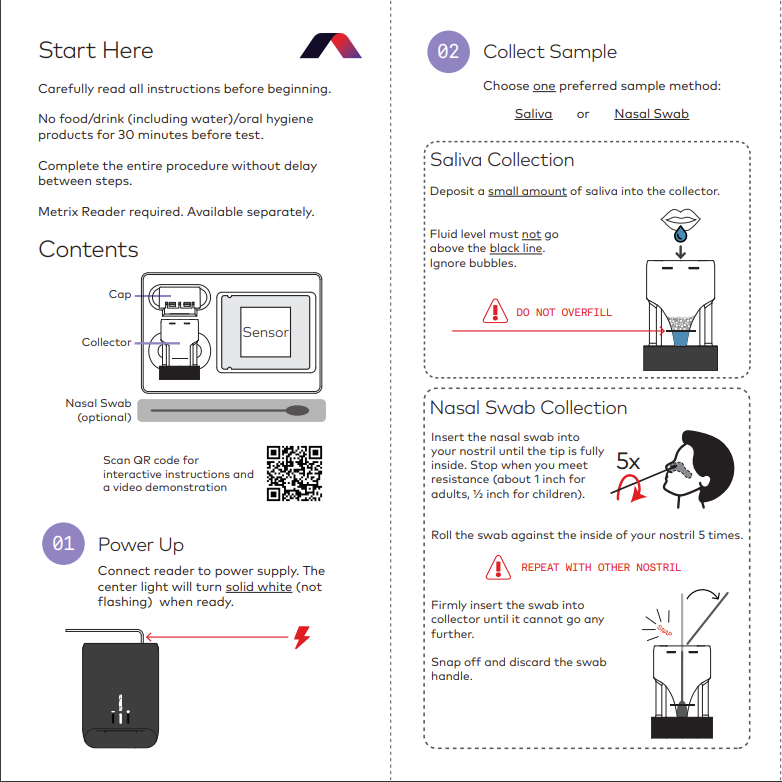
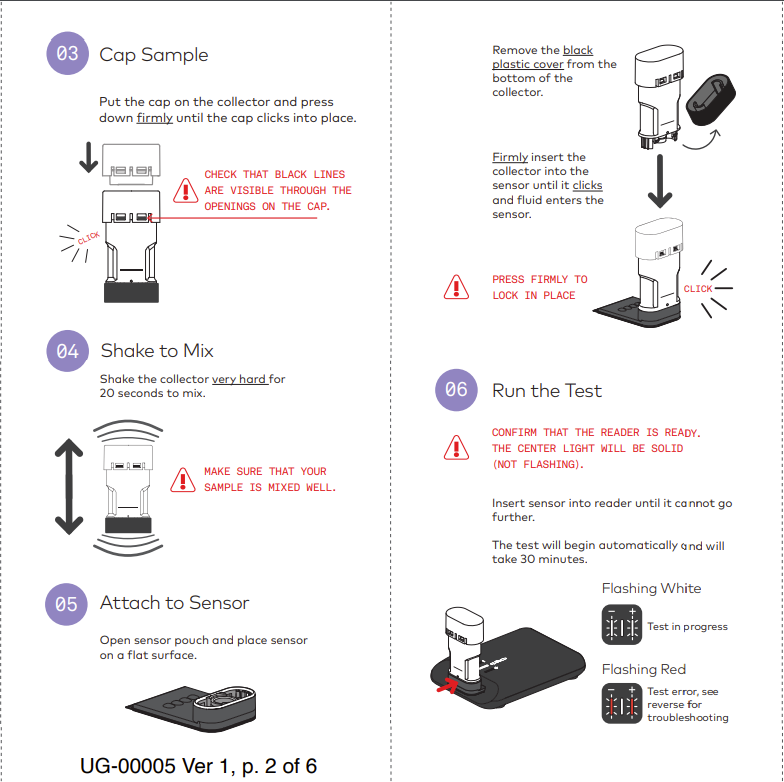

又是一个LAMP,跟Lucira,Detect,一个类型。核心还是等温+直扩。这个公司还是小公司。获得美国FDA授权的经常有不知名小公司,四个获得EUA批准的分子POCT,都是来自小公司的产品,其中Detect 是2020年才成立。这次的 AptitudeDx也是成立没多久,三位创始人中有两位都是毕业于清华大学(中间和右边两位)。

对传染性疾病的控制,很大程度上依赖于对大量人群进行筛查的能力,唾液样本是一个很有吸引力的选择,可以简化高通量检测的采样,更适用于POC检测。
但是唾液中存在多种核酸扩增过程的抑制物,且其中的DNA/RNA含量相对于其他类型样本如鼻咽拭子和血液来说通常较低。这对于开发灵敏的诊断检测,尤其是直接检测,是一个很大的挑战。
来源:IVD工具人
本站文章版权归原作者及原出处所有。内容为作者个人观点,并不代表本站赞同其观点和对其真实性负责,本站只提供参考并不构成任何投资及应用建议。本站是一个个人学习交流的平台,网站上部分文章为转载,并不用于任何商业目的,我们已经尽可能的对作者和来源进行了通告,但是能力有限或疏忽,造成漏登,请及时联系我们,我们将根据著作权人的要求,立即更正或者删除有关内容。本站拥有对此声明的最终解释权。声明:该文章系转载,登载该文章目的为更广泛的传递市场信息,不代表跟公司赞同其观点。文章内容仅供参考。